МЕХАНИЗМЫ РАЗВИТИЯ САХАРНОГО ДИАБЕТА 2 ТИПА ПРИ ОЖИРЕНИИ
Сахарный диабет 2 типа является самым частой патологией органов эндокринной системы. В России сахарным диабетом 2 типа страдает около 9 млн. человек (7% населения страны).
Ключевым механизмом развития заболевания является инсулинорезистентность - снижение биологического ответа клеток на один или несколько эффектов инсулина при его нормальной концентрации в крови. Инсулинорезистентность приводит к неспособности инсулинзависимых тканей (мышечной и жировой) поглощать глюкозу плазмы крови и нарушению синтеза гликогена (полимера глюкозы) в печени.
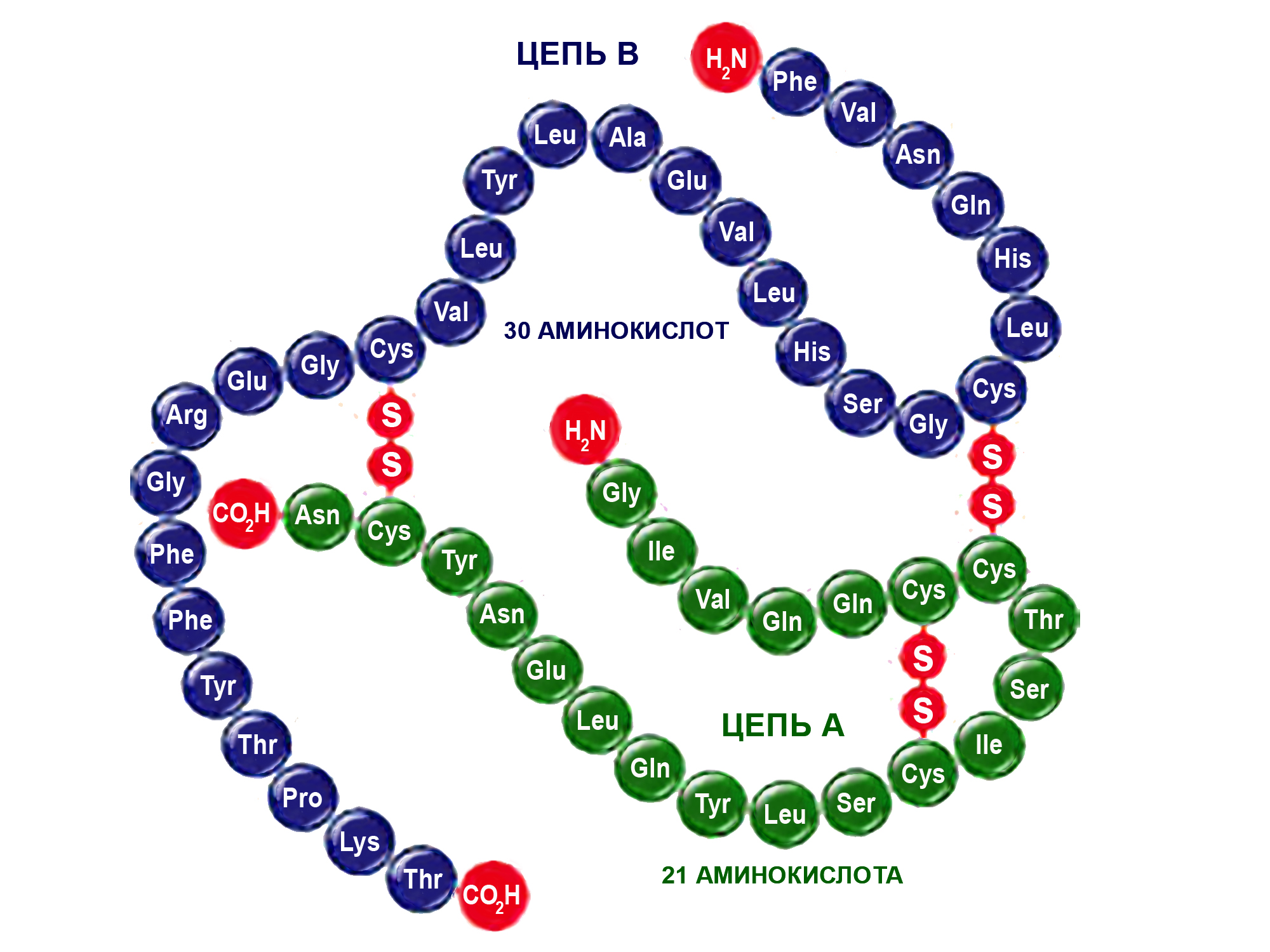
Строение молекулы инсулина
Биологические эффекты инсулина весьма многообразны. Он регулирует активность ферментов гликолиза и гликонеогенеза, синтеза гликогена и гликогенолиза, β-окисления жирных кислот и липогенеза. Инсулин тормозит мобилизацию жиров и захват клетками циркулирующих в крови свободных жирных кислот, потенцирует синтез белков практически во всех тканях, в первую очередь – в скелетных мышцах, миокарде, печени, влияет на захват и транспорт аминокислот (являющихся составными частями всех белков организма) и основных ионов.
Тонкие механизмы развития инсулинорезистентности при сахарном диабете 2 типа на сегодняшний день изучены не до конца. Однако вызывает сомнение, что в основе заболевания лежит нарушение передачи сигнала от рецептора инсулина к внутриклеточным субстратам пути действия гормона.
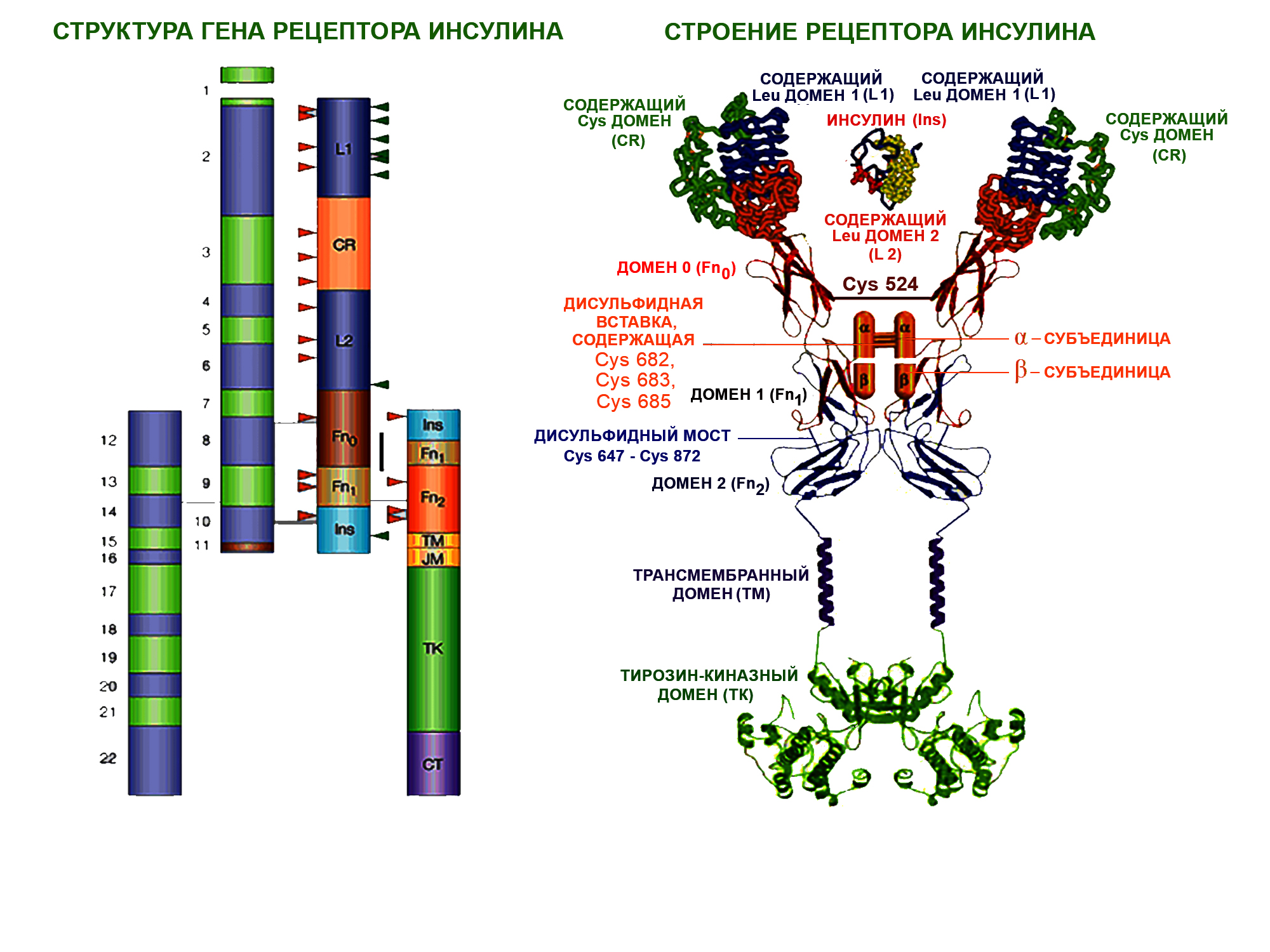
Структура кодирующего гена и строение рецептора инсулина
В норме двухцепочечная молекула инсулина связывается со специальным рецептором, расположенным на мембране клетки, и имеющим в структуре тирозин-киназный фрагмент (участок, обладающий ферментативной активностью). В результате контакта молекулы гормона с рецептором запускается процесс аутофосфорилирования тирозина с последующей активацией белков вторичной передачи сигнала (IRS-1 – субстрата -1 рецептора инсулина, Shc-, SIRP-, Gab-1, Cbl- и др.). Протеины IRS-1 активируют фермент фосфатидил-инозитол киназу-3 [4,5], которая в свою очередь инициирует эффект протеинкиназ В [С]. Протеинкиназы В и С запускают каскад ферментов, регулирующих углеводный и жировой обмен, и вызывают встраивание в мембраны инсулинзависимых клеток (адипоцитов и миоцитов) белков-переносчиков глюкозы (GLUT-4). Таким образом происходит транспорт молекул глюкозы из плазмы крови внутрь клеток.
Параллельно с активацией поступления глюкозы запускаются механизмы синтеза оксида азота в эндотелиальных клетках сосудов мышечной ткани, а также - интенсивного захвата аминокислот и синтеза клеточных протеинов, торможения биохимических процессов апоптоза (естественной гибели клеток).
Другая группа белков вторичной передачи сигнала от рецептора инсулина (Shc-, Sos-, Ras-, Raf-, MAP-) регулирует механизмы митоза и пролиферации (деления клеток), а также активирует синтез медиаторов воспаления.
Столь подробное изложение пути действия инсулина на внутриклеточные процессы позволяет представить многогранность возможных факторов развития инсулинорезистентности. Молекулярными причинами утраты способности передавать сигнал может быть депрессия активности тирозин-киназы IRS-1или фосфатидил-инозитол киназы-3 вследствие различных мутаций гена, кодирующего рецептор инсулина. Возможным вариантом нарушений процесса поступления глюкозы в клетку может быть снижение эффективности протеинкиназ В и С, или структурная неполноценность трансмембранного переносчика глюкозы (GLUT-4).
Все перечисленные механизмы возникновения инсулинорезистентности могут быть врожденными (генетически детерминированными), и описаны в виде определенных синдромов (S. Rabson- E. Mendenhall syndrome, W. Donohue syndrome, инсулинорезистентность типа А).
Однако гораздо чаще нарушение реализации биологических эффектов инсулина возникает в течение жизни под действием дополнительных факторов. Ключевым механизмом развития приобретенной инсулинорезистентности в настоящее время считается снижение активности тирозин-киназы рецептора инсулина (IRS-1). Доказанными биохимическими факторами нарушения трозин-киназного звена передачи сигнала внутри клетки является белок РС-1 (мембранный гликопротеин), избыточно вырабатываемый клетками мышечной и жировой ткани. Блокаторами эффектов тирозин-киназы являются протеинкиназа С и фактор некроза опухоли-α (ФНО-α), также интенсивно синтезируемые адипоцитами (жировыми клетками).
Другим фактором развития инсулинорезистентности является снижение активности фосфатидил-инозитол киназы-3 вследствие дисбаланса ее субъединиц при воздействии некоторых гормонов (глюкокортикоидов, половых стероидов) или избыточного поступления в клетки свободных жирных кислот и триглицеридов, приводящего к накоплению диацил-глирерола.
Помимо описанных общих механизмов нарушения реализации эффектов инсулина при избыточном развитии жировой ткани важнейшую роль в возникновении инсулинорезистентности начинают играть роль биологически активные вещества, вырабатываемые адипоцитами. Метаболиты адипоцитарного происхождения (адипоцитокины) способны влиять на различные биохимические процессы во многих органах и тканях. В настоящее время известно более 100 химических соединений подобного происхождения, многие из которых имеют прямое или опосредованное отношение к развитию инсулинорезистентности.
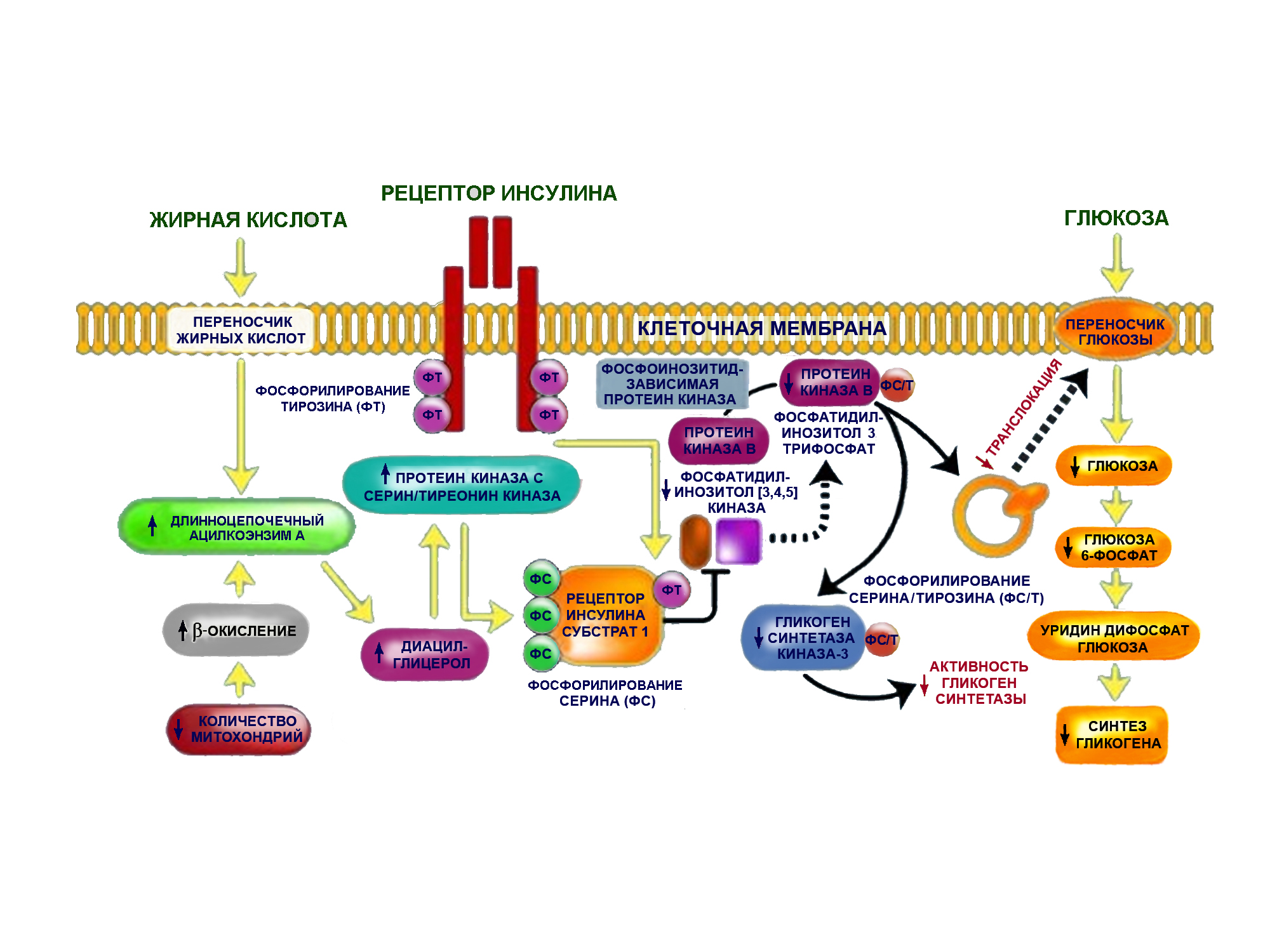
Механизмы развития инсулинорезистентности при ожирении
Лептин – один из первых, идентифицированных адипоцитокинов, кодируемый геном ob (геном ожирения). Помимо адипоцитов продукция лептина выявлена во многих тканях и органах (печени, мышцах, яичниках и др.), что свидетельствует о многообразии его биологических эффектов. Наиболее изученный механизм действия гормона – стимуляция центра насыщения, расположенного в гипоталамусе (участке головного мозга). При повышении концентрации лептина в крови снижается или исчезает чувство. Однако при длительном и стойком повышении уровня гормона развивается лептинорезистентность - невосприимчивость клеток-мишеней гипоталамуса к его воздействию. Лептинорезистентность приводит к избыточному поступлению в клетки инсулинзависимых тканей триглицеридов и свободных жирных кислот. Таким образом возникает инсулинорезистентность.
Адипонектин вырабатывается исключительно адипоцитами и играет важную роль в регуляции метаболизма липидов и углеводов (глюкозы), повышая чувствительность жировой и мышечной ткани к инсулину. Внутриклеточные эффекты адипонектина реализуются посредством активации АМР-киназы и фосфатидил-инозитол киназы-3, регулирующих окисление свободных жирных кислот. Адипонектин снижает продукцию медиаторов воспаления (интерлейкинов-6, интерлейкина-8, ФНО-α и др.) а также тканевых металлопротеинкиназ, угнетающих функцию тирозин-киназы рецептора инсулина (IRS-1).
Снижение уровня адипонектина при избыточном развитии жировой ткани по механизму обратной связи (уменьшении выработки гормона при достижении необходимого уровня его эффекта – создания энергетического запаса клеток) является одним из факторов развития инсулинорезистентности.
Из числа других адипоцитокинов с изученными механизмами действия, снижает чувствительность жировой и мышечной ткани к инсулину резистин. Аналогичным эффектом обладает ангиотензиноген и ряд других гормоноподобных субстанций, вырабатываемых клетками жировой ткани.
Утрата чувствительности тканей к действию инсулина приводит к компенсаторной гиперпродукции гормона β-клетками поджелудочной железы. Повышение концентрации инсулина в плазме крови в течение какого-то времени позволяет преодолевать барьер инсулинорезистентности, сохраняя необходимый уровень поступления глюкозы в клетки. Однако постепенно резервные возможности инсулярного аппарата поджелудочной железы исчерпываются и развивается декомпенсация – сахарный диабет.
Таковы современные представления о развитии одного из самых распространенных заболеваний взрослого населения экономически развитых стран мира – сахарного диабета 2 типа, и роли ожирения в его патогенезе.
