МЕХАНИЗМЫ РАЗВИТИЯ ДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЙ
ОПОРНО-ДВИГАТЕЛЬНОГО АППАРАТА ПРИ ОЖИРЕНИИ
К дегенеративно-дистрофическим заболеваниям опорно-двигательного аппарата человека относятся изменения хрящевых, костных и связочных и мышечных структур скелета, приводящие к нарушению его функции.
Наиболее распространенным дегенеративно-дистрофическим заболеванием опорно-двигательного аппарата является остеоартроз. К остеоартрозу относится разнообразная по причинам возникновения группа патологических изменений суставов со сходными биологическими, морфологическими и клиническими проявлениями. Основой данной группы заболеваний является повреждение различных тканей сустава (субхондральных костных структур, синовиальной капсулы, связок и околосуставных мышц), но в первую очередь – хряща.
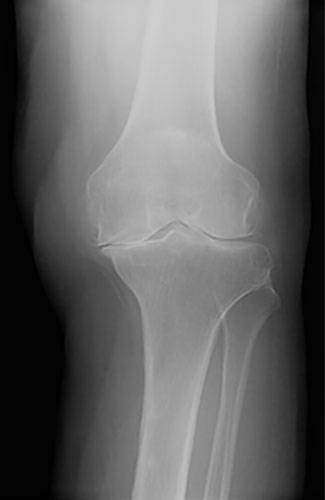
Остеоартроз левого коленного
сустава
(Рентгенография в прямой проекции)
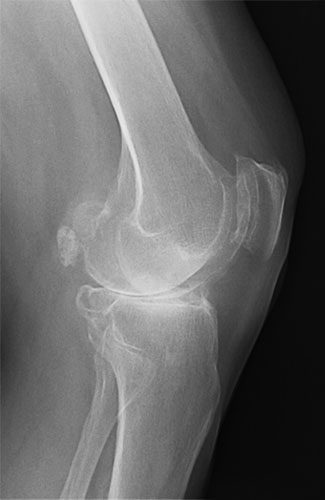
Остеоартроз левого коленного
сустава
(Рентгенография в боковой проекции)
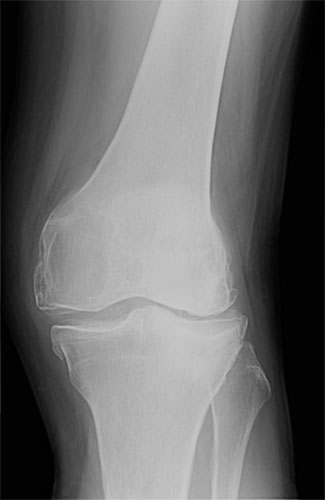
Остеоартроз левого коленного
сустава
(Рентгенография в прямой проекции)
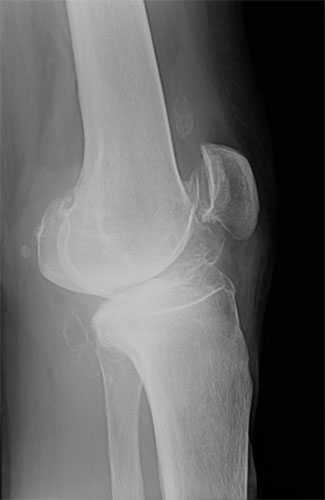
Остеоартроз левого коленного
сустава
(Рентгенография в боковой проекции)
Остеоартроз является причиной нетрудоспособности и невозможности самообслуживания 20% населения земного шара, занимая в структуре всех заболеваний суставов 80-85%.
Природа развития данной группы патологических состояний разнообразна, однако, ведущими являются две группы причин: перегрузка и снижение устойчивости тканей сустава к физиологической нагрузке, вызывающих изменение структуры хряща. Ключевыми факторами возникновения остеоартроза являются повреждение (травма, стереотипные движения), приобретенные нарушения функции (удаление менисков), возрастные изменения (нарушения синтеза компонентов хрящевой ткани, синовиальной жидкости и т.д.). Важную роль могут играть генетические причины (наследуемые формы эрозивного артроза, синдром Стиклера и др.), воспаление, избыточная масса тела, заболевания периферических нервов, а также – болезни “накопления” (подагра и др.).
Хрящевая ткань представляет собой разновидность соединительной ткани, образованная хрящевыми клетками (хондроцитами) и большим количеством плотного межклеточного вещества. Хондроциты имеют разнообразную форму и лежат одиночно или группами внутри хрящевых полостей. Межклеточное вещество (матрикс хряща) состоит из молекул гликопротеидов (хондроитинсульфата, кератансульфата), обеспечивающих устойчивость к сжатию, и волокон коллагена, определяющего способность противостоять растяжению. В зависимости от строения волокнистого компонента межклеточного вещества выделяют три вида хряща: гиалиновый (покрывает поверхность всех суставов), эластический (образует каркас ушных раковин и гортани) и волокнистый (располагается в местах перехода связок в гиалиновый хрящ).
Синтез всех компонентов ткани осуществляется специализированными клетками – хондроцитами. В норме деградация (разрушение) и регенерация (восстановление) клеточных и межклеточных структур хряща находятся в равновесии и поддерживаются многочисленными механизмами. Развитие дегенеративно-дистрофических заболеваний опорно-двигательного аппарата является следствием преобладания процессов разрушения над процессами синтеза.
Метаболизм хондроцитов (процессы жизнедеятельности клетки), в том числе - синтез компонентов матрикса хряща, регулируется целым рядом биологически активных веществ (гормонов, цитокинов, медиаторов и т.д.). Воздействие интерлейкина-1 (ИЛ-1) вызывает распад матрикса хряща и угнетение синтетической функции хондроцитов. Аналогичным эффектом обладают и многие другие провоспалительные (инициирующие воспаление) цитокины: ИЛ-6, фактор некроза α (ФНО-α), циклоксигеназа-2 (ЦОГ-2), простагландины (ПГ), оксид азота (NO) и др. Медиаторы воспаления стимулируют синтез протеолитических ферментов (коллагеназ) хондроцитами, активируют плазмин и металлопротеазы хрящевого матрикса. В результате действия протеолитических ферментов происходит нарушение пространственной ориентации и структуры нитей фибрина, приводящее к значительному снижению функциональной устойчивости хряща к механическим нагрузкам. Параллельно с изменением свойств фибриновой сетки хряща происходит элиминация важнейших компонентов матрикса – хондроитинсульфата, креатансульфата и гиалуроновой кислоты.
Механизмами регенерации хряща являются пролиферация (деление) хондроцитов и активация в них метаболических процессов, направленных на возмещение разрушающихся компонентов матрикса: гликопротеинов, коллагена и других белков. Повышение уровня тканевых ингибиторов (блокаторов) протеиназ уменьшает интенсивность механизмов деградации гликопротеинов и коллагена, факторы роста (инсулинподобный фактор роста, трансформирующий фактор роста β) стимулируют пролиферацию хондроцитов и фибробластов (клеток соединительной ткани), принимающих активное участие в синтезе протеинов матрикса.
Изменения строения хрящевой ткани суставов приводят к возникновению патологической реакции субхондральной (расположенной под хрящом) кости с нарушением ее микроциркуляции (кровообращения в капиллярах и тканевого обмена веществ), возникновением субхондрального остеосклероза и ее структурной перестройки с последующим формированием остеофитов (патологических костных разрастаний вокруг и в просвете сустава). Параллельно с изменением костных структур происходят изменения мягких тканей сустава: связочного аппарата, околосуставных мышц. Сустав полностью утрачивает функцию, развивается стойкий болевой синдром не только при движении, но и в покое.
Аналогичные процессы происходят не только в суставах нижних конечностей, несущих наибольшую нагрузку (тазобедренных, коленных), сочленениях позвоночника – развивается остеохондроз.
По мере прогрессирования остеоартроза и остеохондроза нарушения деятельности определенного сустава (группы суставов) или сегмента позвоночника происходит перераспределение нагрузки и изменения функции других отделов опорно-двигательного аппарата. Процесс приобретает системный характер.
Избыточная масса тела является одним из ключевых факторов развития остеоартроза за счет увеличения механической нагрузки на суставы и связочный аппарат нижних конечностей и позвоночника.
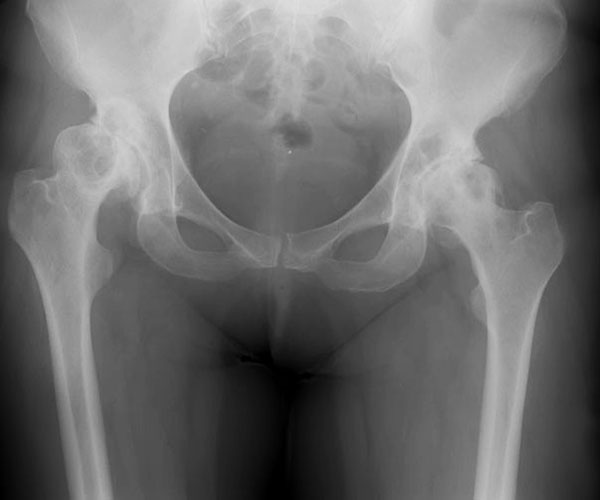
Остеоартроз правого тазобедренного сустава при ожирении
(Рентгенография в прямой проекции)
Нагрузка на каждый квадратный сантиметр мениска коленного сустава человека с массой тела 65-70 кг составляет 4,5 килограмма. При массе тела 100 килограммов нагрузка увеличивается до 6,9 кг на 1 см2, а весе 120 кг - до 8,3 кг на 1 см2 (то есть, почти в два раза, по сравнению с давлением при физиологической массе тела). Клинические исследования показывают, что увеличение индекса массы тела на одну единицу повышает риск повреждения хрящевой ткани на 11 %. Превышение нормальной массы на 20% увеличивает риск развития остеоартроза коленных суставов в 10 раз. Напротив, снижение избыточной массы тела всего на пять килограммов, вдвое снижает риск возникновения артроза той же локализации.
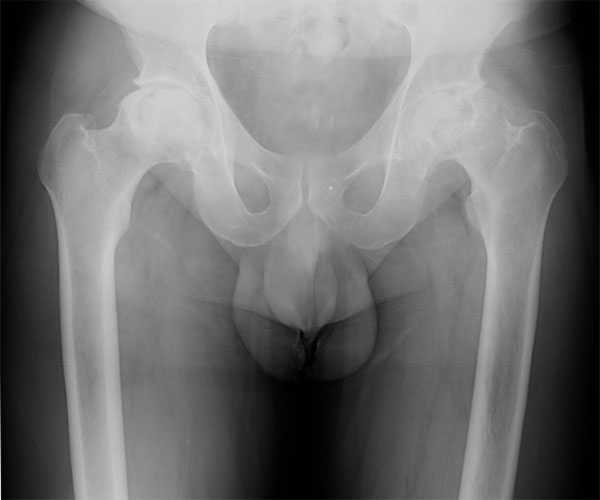
Остеоартроз левого тазобедренного сустава при ожирении
(Рентгенография в прямой проекции)
Однако механическое повреждение хрящевой ткани является не единственным патогенетическим механизмом развития заболевания при ожирении. Метаболические нарушения (гипергликемия, дислипидемия и т.д.), возникающие при избыточной массе тела, значительно ускоряют прогрессирование дегенеративно-дистрофических изменений суставов. Стойкое повышение концентрации глюкозы в плазме крови приводит к изменению строения макромолекул матрикса хрящевой ткани. Важную роль играют и нарушения микроциркуляции, возникающие вследствие ангиопатии (повреждения капилляров) при гипергликемии. Повышение уровня холестерина в крови ассоциируется с генерализованным (поражающим многие суставы) остеоартрозом.
Важную роль в повреждении хрящевой ткани играют и биологически активные вещества, вырабатываемые жировой тканью – адипокины. Резистин, лептин и адипонектин обнаруживаются при исследовании синовиальной (внутрисуставной) жидкости при избыточной массе тела. Лептин (наиболее изученный адипокин) индуцирует синтез интерферона-1 (ИФР-1) и провоспалительных цитокинов, оказывающих токсическое воздействие на хондроциты. Этим обстоятельством, по-видимому, объясняется развитие остеоартроза мелких (не нагружаемых) суставов при ожирении.
Прогрессирование остеоартроза и остеохондроза приводят к снижению физической активности и, следовательно, – усугублению ожирения. Патологический круг замыкается.
Таковы на сегодняшний день представления о взаимосвязи избыточной массы тела и дегенеративно-дистрофических изменений опорно-двигательного аппарата человека.
